| ポリクローナル抗体・モノクローナル抗体の受託作製ならティー・ケー・クラフト。 抗体精製・標識、抗原カラム作製、腹水作製、細胞培養、各種動物血清も扱っております。 |
 |
| |||||||||||||||||||||||||||||||||||||||||||||
抗体の反応性が悪い、と一口に言っても様々な原因が考えられます。まず始めにどの様な反応性の悪さが、今までに寄せられているのか書き出してみました。 |
|
| ELISA ・発色しない ・バックグラウンドが高い ・同じ程度に発色してしまう(発色に変化がない) |
ウエスタンブロット ・発色しない ・全てに色がついてしまう ・何本もバンドが染まってしまう ・メンブレンが全て染まってしまった |
| 免疫組織染色 ・発色しない ・非特異反応が出てしまう ・関係のない部位が染まってしまう |
アフィニティー精製 ・抗体でカラムを作製したが、目的物質を精製できない |
|
上記の様に、症状は様々ですが共通して言えることは以下の3つに絞られてくると思います。 ・抗原と抗体の反応性が弱い。 ・非特異吸着を起こしてしまう。 ・プロトコール、手技による、失敗。 では、まず抗原と抗体の反応性が弱い。ということについて考えてみることにします。 |
|
反応性が弱いとき(抗体価が低い場合…)の原因 |
|
| ・免疫抗原が免疫動物にとって異物と認識されず、抗体価があがらなかった これは、計画段階で未然に防ぐことができ、その一つとしてホモロジー検索が重要になります。特にペプチドを抗原とした場合には注意が必要です。また、インスリンの様な動物種間であまり差がない蛋白質なども当てはまります。 ・抗原の精製度が低すぎた 抗体を作製するときに、よく抗原の純度は100%でなければいけないのか? と言うようなご質問を受けますが、必ずしもそうでは無く、7〜8割程度の精製 度でもうまくいく場合があります。ただし、作製した抗体を使う段階において、かなりの精度が要求される測定系を用いる場合などには注意が必要になります。 ・免疫期間が適当ではなかった(短かった) 免疫期間が短かった場合には、当然初期反応型の抗体が多くなってしまい、IgGを精製した段階で反応性が弱くなる原因となります。 |
|
非特異吸着を起こす原因 |
|
| ・抗原の精製度が低すぎた これに関しては、前にも記しましたが、蛋白抗原などを組織から精製する場合等、どうしても同じ組織からの不純物の混入が考えられ、それに対する抗体が産生されてしまいます。 ・抗体の精製度が低い 一般に低感度のアッセイ系においては、それ程問題とならないことが多いですが、これが高感度を必要とするアッセイ系の場合、非特異反応の原因となってしまいます。 ・アッセイ系(反応系)の手技の見直し この点につきましては、優れた書籍が多く出版されておりますので、そちらをご参考にしてください。 |
|
| と、言うように原因についてはさまざまな点が挙げられますが、実際に抗体の反応性が悪かった場合、どの様な解決策が考えられるのでしょうか? | |
| ★問題点をクリアにし、新たに抗体を作り直す。 これが、一番の解決策ではないかと個人的には考えておりますが……。そんなに簡単に諦めきれないと言う場合には……。 |
|
| ☆抗原カラムを作製 抗原に特異的な抗体のみを精製する。(いわゆる、抗体の特異化) |
|
抗原カラムとは? |
|
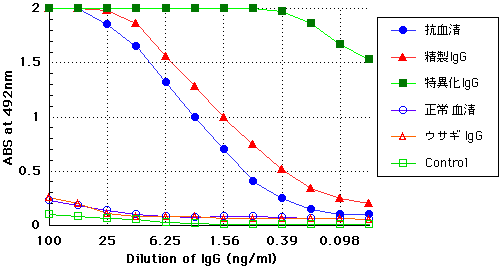
| 免疫に用いた抗原をアガロースゲル等に固定した後、カラムに詰めてやると、作製した抗体を通過させることによって、抗原と反応させ、特異抗体のみを精製す ることができます。では、抗原カラムを作製し、特異化した抗体ではどの様な違いが出てくるのでしょうか? 以下はその一例です。 | |
 |
|
| 上図は、 抗血清、プロテインA精製IgG、特異化IgG 、それぞれを用いてELISAを行った場合のグラフになります。縦軸が492nmの吸光度、横軸が100ng/mLから倍々希釈していったIgGの濃度になります。 | |
| 一見すると、特異化IgGの反応性が強くなっている様に思えます。しかし実際の力価は元の抗血清と同じままで、溶液中に含まれる目的IgGの量が多いだけなのです。つまり、抗原に特異的なIgGのみが100%の割合で含まれているために、同じ濃度でも反応が強く出ているのです。 | |
| では、どうして抗体の特異化なんて勧めるのでしょう……? それは、非特異吸着の低減、少量のIgGで反応する等のメリットがあるからです。 でも、注意点として以下のことが挙げられます。 |
|
| ・不純物の多い抗原でカラムを作っても、意味がない。 ・精製IgGの約10分の1以下程度の抗体量になる。 ・抗体自身の性格(力価等)を変える事ではないので、 大元の抗体がしっかりと出来ていない場合、特異化しても無意味である。 |
|
| 今回、抗体の特異化について少しだけ書き出してみましたが、あくまでもポリクローナル抗体を使用するときの一つの手段としてお考えください。できれば、この様な苦労(?)をせずに高力価の抗体を精製する程度で使えれば、それに越したことはないのですから……。 | |
| 第2回はこちら | |